一、研究背景
当前药品说明书简化版的申报材料比对工作主要依赖人工完成,流程繁琐、耗时且易受主观因素影响,增加了审批人员的工作负担,影响药品说明书备案批进度。尤其是在药品创新不断加快的背景下,传统的审批模式难以适应高效、精准的审查需求。亟需引入自动化比对工具,以人工智能技术为基础,通过自动化系统替代人工对比,进一步提升审批效率,减少人为误差。同时,为推进药品说明书适老化及无障碍改革试点工作,国家药监局也发布了药品说明书简化版相关的政策文件,为实现药品说明书简化版申报材料智能化审查提供了政策背景和需求导向。
二、研究内容
为快速、准确地识别和比对申报材料中的关键信息,辅助审批人员做出科学合理的判断,提升审批流程的效率,整个课题的研究内容分成六部分,一是建设药品说明书智能化文档解析功能;二是建设药品说明书智能比对引擎;三是实现简化版与完整版说明书关键字段一致性检查;四是建设政策法规数据库;五是实现药品说明书非结构化文件存储;六是建设药品说明书结构化数据库。
三、研究成果
目前,本课题已经取得了七个方面的研究成果:一是建设智能化文档解析模块,利用光学字符识别(OCR)技术,处理多种格式文档,自动提取并分类存储关键信息,方便后续对提交的药品说明书进行结构化数据比对与查询。二是建立智能比对模块,负责对不同类型、不同版本的药品说明书进行比对,特别是对药品说明书简化版信息,能够快速检测出简化版和完整版之间的差异。三是建立药品说明书相关政策法规数据库,汇集药品说明书相关政策法规类文件,如《药品说明书(简化版)及药品说明书(大字版)编写指南》(以下简称《指南》)等。用于判断申报的说明书简化版是否符合要求。四是对药品说明书非结构化文件按照类型、版本进行分类存储,将药品注册申报过程中上传的药品说明书(完整版)、药品说明书(大字版)、药品说明书(简化版),以及历史版本的药品说明书文件进行精细化分类存储,并提供不同权限的角色访问机制,提升系统的安全性。五是建立一致性检查模块,探索利用人工智能大语言模型重点检查药品说明书简化版与《指南》要求字段的一致性,确保数据准确无误。自动识别不一致之处,提示监管员进行检查和修正。六是建立药品说明书结构化数据库,实现高效的数据搜索机制,用于数据查询检索与统计分析。七是编制形成《药品说明书简化版申报材料自动化比对功能可行性方案》,阐明本课题研究在技术创新、经济和社会效益方面的可行性。
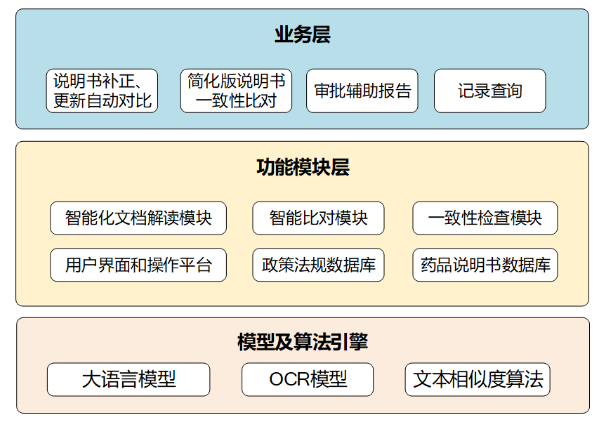
▲图基于AI大语言模型的药品说明书简化版申报材料智能审查功能架构图
四、应用成效
目前,课题组的相关研究已经取得了部分成效,一是通过课题研究,实现不同版本的药品说明书自动比对,能够显著减少人工比对的工作量,提升监管人员的工作效率;二是通过建立药品说明书一致性检查功能,能够降低人工操作中可能出现的遗漏和错误,确保申报材料内容的准确性;三是通过引入人工智能大模型语言模型技术,提高药品说明书审查效率和科学性,有助于推动业务流程智能化和规范化发展,为药品智慧监管工作提供有力的技术支持,具有显著的经济和社会价值。