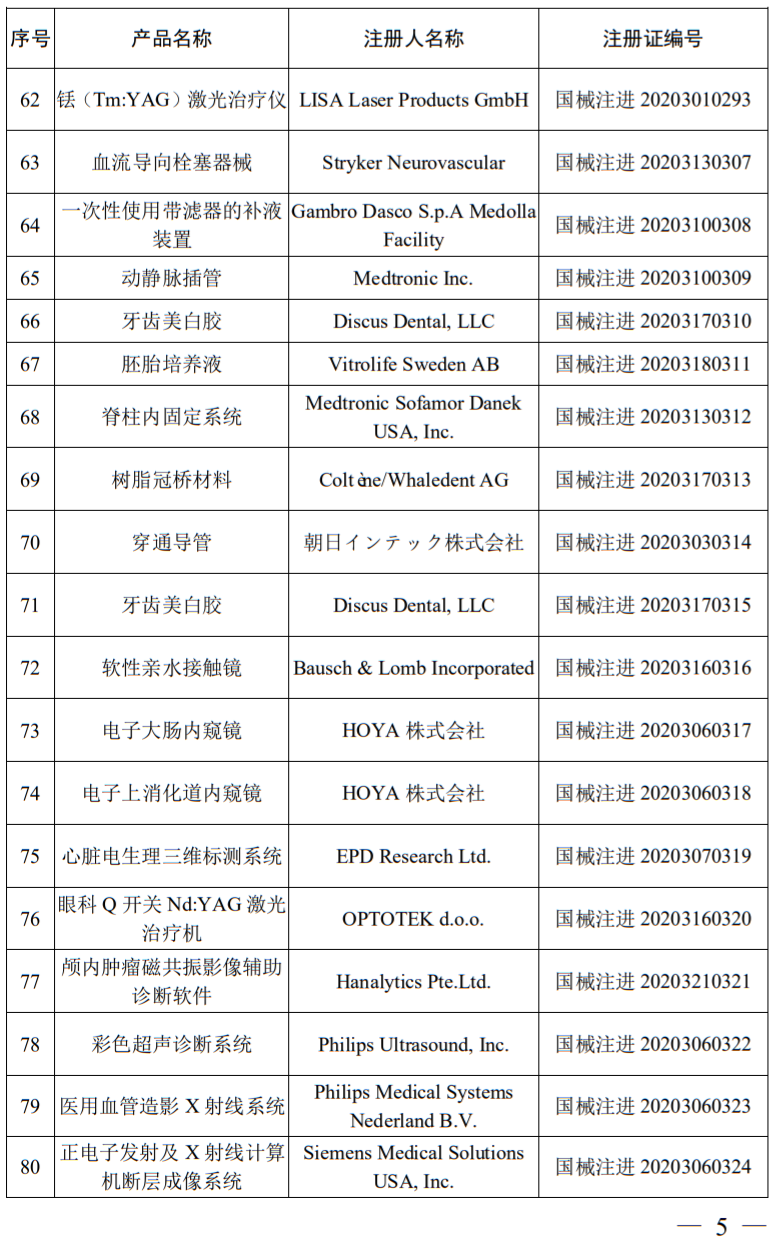
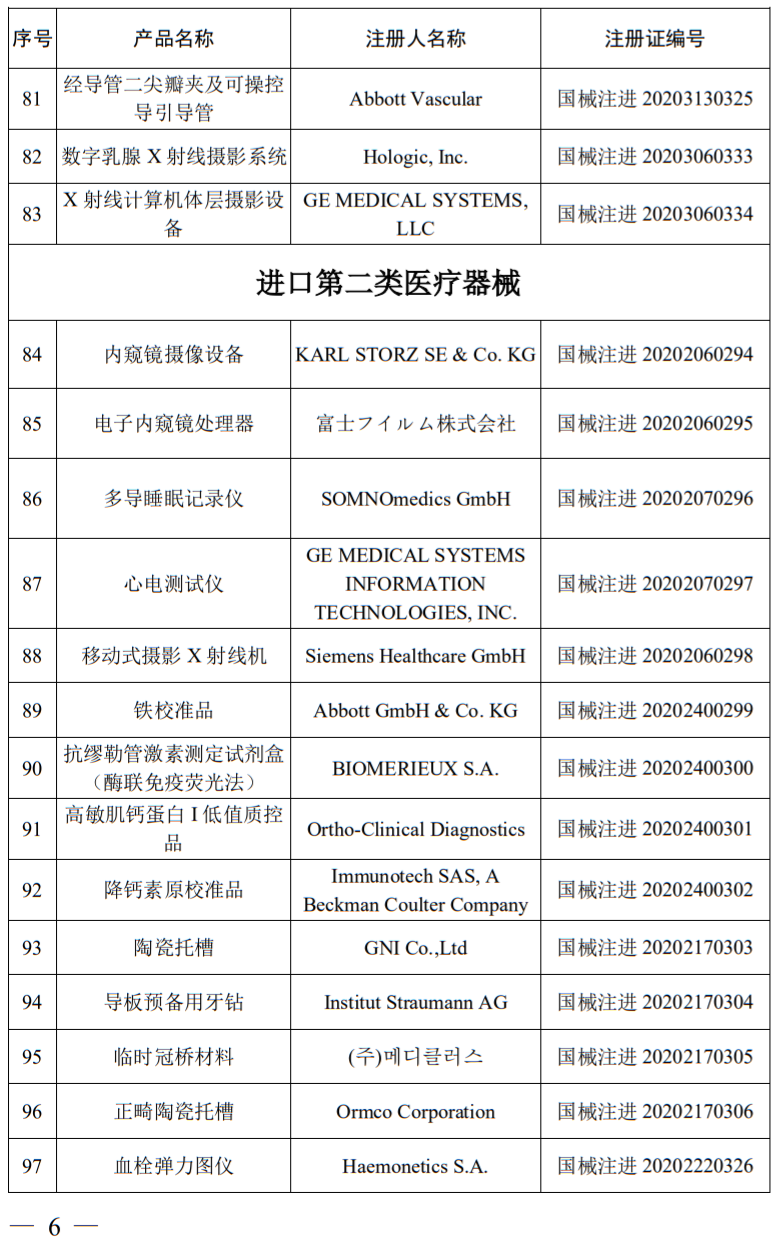
公告显示,2020年6月,国家药品监督管理局共批准注册医疗器械产品107个。其中,有比较热门的冠状病毒检测试剂盒和乙肝病毒检测试剂盒,以及境内第三类医疗器械产品59个,进口第三类医疗器械产品24个,进口第二类医疗器械产品24个。
据华健器械梳理,技术含量最高设备价格也最贵的第三类进口医疗器械主要包括飞利浦的彩超和x射线设备以及GE的X线设备,本次获批器械涉及美敦力、飞利浦、西门子、雅培、GE、罗氏诊断、史赛克、迈瑞、乐普、先健科技、东软、山东新华等械企产品。


0评论2025-11-092
0评论2025-11-092
0评论2025-11-092
0评论2025-11-0526
0评论2025-11-0529
0评论2025-11-0219